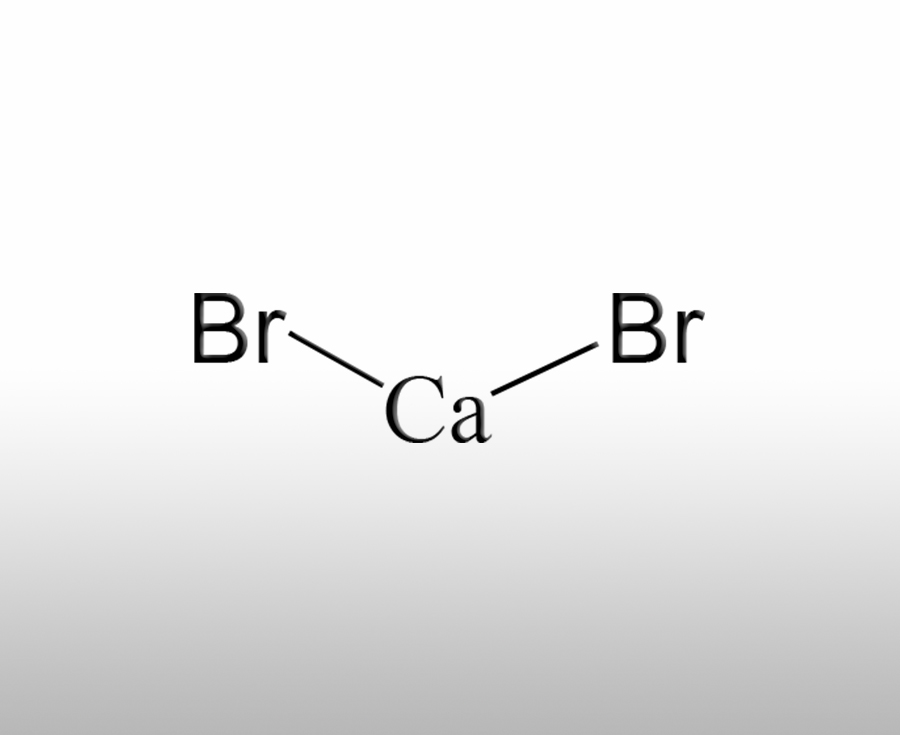
溴化钙为什么可以作为分析试剂
溴化钙(CaBr₂)能作为分析试剂,主要与其化学性质、稳定性及反应特性密切相关,以下从多个维度解析其作为分析试剂的优势:信息来源:www.worldbrom.com | 发布时间:2025年06月11日
一、化学性质的适用性
1.可溶性与离子特性
溴化钙易溶于水,形成无色透明溶液,解离出 Ca²⁺和 Br⁻离子。这种可溶性使其在溶液分析中便于配制标准溶液,也适用于沉淀反应、络合反应等分析场景。
例:在定性分析中,Br⁻可与 Ag⁺反应生成淡黄色 AgBr 沉淀,用于溴离子的鉴定;Ca²⁺可与草酸根(C₂O₄²⁻)反应生成 CaC₂O₄沉淀,用于钙离子的定量分析。
2.中等强度的还原性
Br⁻具有一定的还原性,可在氧化还原滴定中作为还原剂或参与反应。例如,在酸性条件下,Br⁻可被 KMnO₄或 K₂Cr₂O₇氧化,用于滴定分析中测定氧化剂的浓度,或作为媒介间接测定其他物质(如通过 Br⁻与 ClO⁻的反应测定漂白剂中有效氯含量)。
二、稳定性与纯度可控性
1.物理化学稳定性
溴化钙在常温下不易分解,固体形态吸湿性较低(相比氯化钙等强吸湿性试剂更易保存),水溶液在中性或弱酸性条件下稳定,不易被空气中的氧气氧化,因此试剂保存周期较长,适合作为标准试剂使用。
高温下熔融状态的溴化钙也相对稳定,可用于某些高温分析实验(如矿物熔融后的成分分析)。
2.高纯度制备可行性
通过结晶、萃取等工艺可制备高纯度(如分析纯级别,纯度≥99.0%)的溴化钙,杂质(如氯化物、硫酸盐、重金属离子)含量低,避免对分析结果产生干扰。例如,在光谱分析或痕量元素检测中,高纯度溴化钙可作为基体改良剂或溶剂。
三、在分析方法中的具体应用场景
1.沉淀滴定与重量分析
作为溴离子的标准来源,用于沉淀滴定法测定 Ag⁺、Pb²⁺等金属离子。例如,以溴化钙为滴定剂,在中性溶液中与 Ag⁺反应生成 AgBr 沉淀,用曙红等吸附指示剂确定终点,实现对银离子的定量分析。
在重量分析法中,溴化钙可参与形成难溶溴化物沉淀(如与 Hg²⁺生成 HgBr₂),通过沉淀的质量计算目标物质的含量。
2.络合与配位反应
Ca²⁺可与 EDTA(乙二胺四乙酸)形成稳定的络合物,溴化钙溶液可作为钙离子的标准溶液,用于 EDTA 滴定法测定其他金属离子(如通过置换滴定间接测定 Al³⁺含量)。
此外,Br⁻可与某些金属离子(如 Cu²⁺)形成络离子(如 [CuBr₄]²⁻),改变溶液颜色或性质,用于比色分析或配位平衡研究。
3.作为电解液或介质
在电化学分析中,溴化钙溶液可作为支持电解质,因其离子电导率较高,且 Br⁻的氧化还原电位较稳定,适合伏安法、电位滴定等实验。例如,在测定某些有机物的电化学性质时,溴化钙可提供稳定的离子环境。
4.光谱分析辅助试剂
在原子吸收光谱(AAS)或电感耦合等离子体光谱(ICP)中,溴化钙可作为基体改进剂,抑制待测元素的电离干扰或提高原子化效率。例如,测定土壤中的痕量铅时,加入溴化钙可增强铅的信号强度,提高检测灵敏度。
四、安全性与操作便利性
相比其他含溴试剂(如溴水、溴酸钾),溴化钙的挥发性低、毒性较小(LD₅₀大鼠口服约 3.35 g/kg),操作时对人体危害较低,且储存条件简单(密封存放于干燥处即可),适合实验室常规分析使用。
其水溶液呈中性或弱酸性(取决于制备工艺),无需额外调节 pH 即可用于多数分析反应,简化了实验步骤。
上一条:
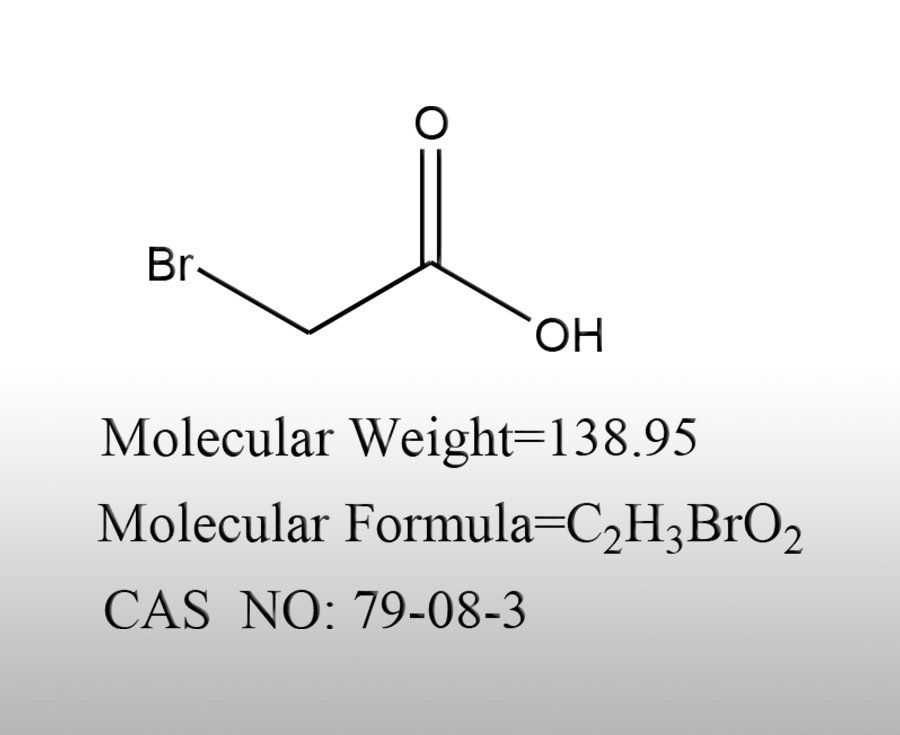
简述溴乙酸的用途
下一条:
在化工行业中溴酸钠有着哪些作用